臨床研究(治験以外)を始めたい方へ
臨床研究(治験以外)実施の流れ
- 臨床研究、と一言でいっても適応外の薬を用いてプラセボと比較するようなものから、通常診療で得られた情報を後ろ向きに解析する観察研究まで様々です。
- 臨床研究を実施するためには、その研究内容の科学的妥当性や被験者に対する倫理的配慮の妥当性などについて、倫理審査委員会で中立的な立場で審査される必要があります。
- 研究の内容によって守るべき法律や指針は異なるため、申請する倫理審査委員会、必要書類が異なります。
- 自分の研究課題がどの倫理審査委員会に申請すればよいのかわからない方は、下記のフローからまずはご確認ください
倫理申請 - わかる方は表から、以下の計画中~終了までの流れを確認の上、必要書類を「書類ダウンロードページ」からご準備ください。
以下の表ではそれぞれの申請先(倫理審査委員会)ごとに必要な工程を
〇(必須)
△(場合により必要)
-(不要)
でお示しします。
ご不明点のある方は、「相談フォーム」からお問い合わせください。
申請
| 工程 / 申請先 | 再生 | CRB | 病倫理 | 病生命 | 病観察 |
|---|---|---|---|---|---|
| 振り分け会議※ |
- |
△ |
△ |
○ |
△ |
| 書類チェック |
|||||
| 申請 |
|||||
| ヒアリング (事前審査) |
○ |
△ |
|||
| 倫理審査委員会 |
○ |
||||
| 施設長から許可の通知 | ○ |
||||
振り分け会議:申請された研究課題について、どの倫理委員会で審議されるべきか確認する会議(現在は遺伝子情報を含む研究を中心に扱っています)。
届出と実施
終了
倫理審査委員会などの略称
- 再生
- …… 千葉大学特定認定再生医療等審査委員会
- CRB
- …… 千葉大学臨床研究審査委員会
- 病倫理
- … 附属病院 臨床研究倫理審査委員会(侵襲あり)
- 病生命
- … 附属病院 生命倫理審査委員会(侵襲なし・遺伝子情報を扱う)
- 病観察
- … 附属病院 観察研究倫理審査委員会(侵襲なし・遺伝子情報を扱わない)
有害事象発生時の対応
侵襲を伴う臨床試験の実施中に有害事象の発生を認めた場合は、被験者に対して必要な医療を提供するだけでなく、研究として適切にカルテ記載を残し、症例報告書を作成する必要があります。
また、当該研究に対応する法律や指針に則り、病院長への報告、倫理審査委員会への報告、厚生労働大臣への報告などを行うことが求められます。
有害事象の重篤度、因果関係の有無、予測可能性により必要な対応が異なります。
以下のフローチャートを参照し、ご対応ください(特定臨床研究の場合はこちら(外部サイト))。対応に迷われる場合は、臨床試験部へご相談ください。
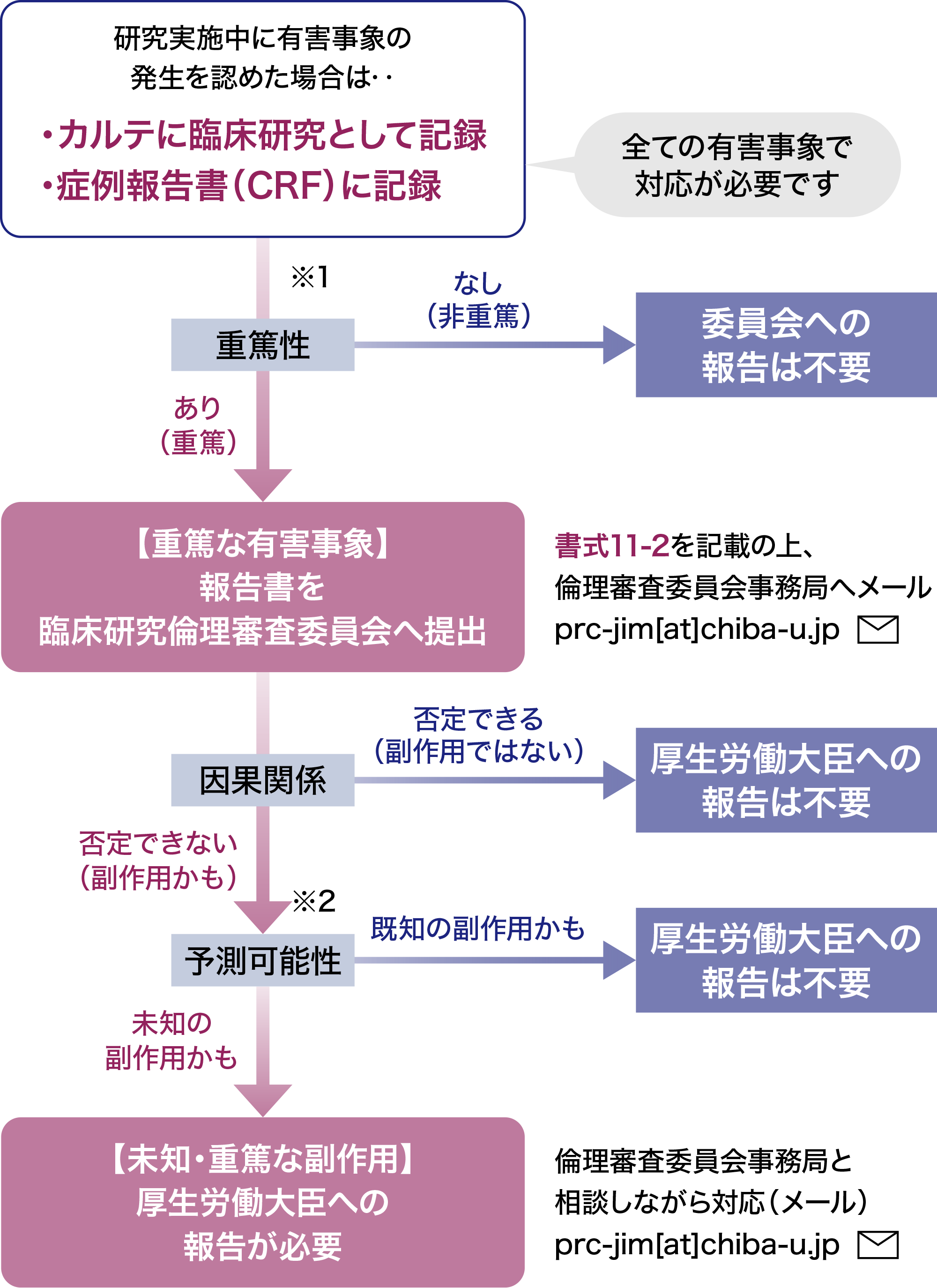
※1 重篤性の判断
重篤
以下いずれかに該当するもの
- 死に至るもの
- 生命を脅かすもの
- 治療のための入院または入院期間の延長が必要となるもの
- 永続的または顕著な障害・機能不全に陥るもの
- 子孫に先天異常をきたすもの
非重篤
上記1~5に該当しないもの
※2 予測可能性の判断
未知
研究計画書、インフォームドコンセントの説明文書等に記載されていないもの、または記載されていてもその性質もしくは重症度が記載内容と一致しないもの
既知
研究計画書、インフォームドコンセントの説明文書等に記載されているもの
臨床研究倫理審査委員会への報告様式は書類ダウンロードより入手してください。
保険の加入について
侵襲(軽微な侵襲を除く。)を伴う研究であって通常の診療を超える医療行為を伴うものを実施しようとする場合(特定臨床研究を含む)の実施時には、 健康被害への補償のため原則としてあらかじめ適切な保険に加入する必要があります。下記、臨床研究保険への加入手順を参照しご対応ください。対応に迷われる場合は臨床試験部へご相談ください。
臨床研究保険への加入手順
①必要書類の作成:
研究計画書、説明同意文書を作成
②必要書類の提出:
附属病院研究推進課研究支援係(内線6665)に提出
メールアドレス:byoin-kshien[at]chiba-u.jp
メールの件名に【保険見積依頼】を記載し、データにて送付ください
保険代理店を経て保険会社へ見積依頼※
研究推進課経由で見積り依頼をしますので、研究者個人で依頼しないでください
見積り結果が出るまで2~3週間要することをご了承ください
③加入手続き:
倫理審査委員会の開催後、最新の研究計画書、説明同意文書、審査結果通知の写し又は審査日、保険料の支払経費(プロジェクトコード等)を研究支援係に連絡
④保険の契約
⑤契約後の対応:
臨床研究実施(経過、終了)報告書に記載する


