実際の支援例
川崎病に対するシクロスポリンAの適応拡大を目的とした医師主導治験における支援内容
医師主導治験の業務をクリックすると支援内容の詳細がご覧いただけます
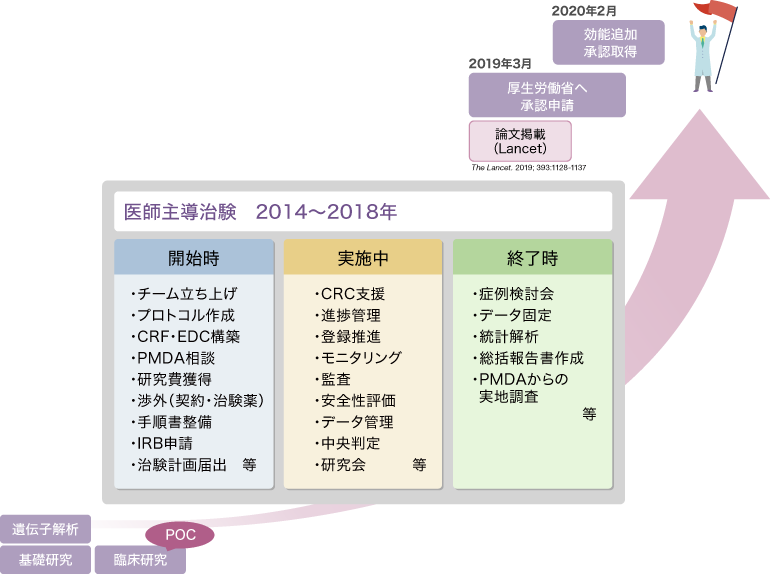
開始時
チーム立ち上げ
千葉大学医学部附属病院、東京女子医科大学八千代医療センター、和歌山県立医科大学附属病院の責任医師を交えた調整会議を定期的に開催し、治験の円滑な実施のため管理を行いました。
関連部署
企画調整室 / 調整事務局 モニタリング室 データマネジメント室 生物統計室 CRC室
本治験が円滑に実施されるように、研究計画の初期段階からコンサルテーションを行い、研究責任者や関連部門と連携して、プロトコル作成を行いました。
関連部署
企画調整室 / 調整事務局 モニタリング室 データマネジメント室 生物統計室 CRC室
プロトコルに基づいたCRFを設計し、EDCを構築しました。設計時には、プロトコルで必要とされている項目が網羅されていること、項目間で記入形式や方法が一致していることに留意しました。
関連部署
データマネジメント室
PMDA相談
治験の対象者、治療デザイン(用法用量・対照薬)及び医薬品の有効性・安全性の評価方法等、治験の骨子となる項目の設定の妥当性については、予めPMDAへ相談し、合意を得ておくことが必要です。臨床試験部は、PMDA相談の申込・相談資料作成から相談当日の同席まで支援を行っています。KAICA Trialでは、様々あるPMDA相談区分のうち、「医薬品戦略相談」に申込み、試験デザインや申請データパッケージの妥当性について助言をいただきました。
関連部署
企画調整室 / 調整事務局
研究費獲得
当時は、AMEDではなく、公益社団法人日本医師会 治験推進センターが厚生労働省の医師主導治験の研究費の配分をしていました。医師会で開催されました採択の会議では、研究責任者である公衆衛生の教授と臨床試験部長がそれぞれ基礎研究のパートと臨床試験のパートについてプレゼンを行いました。当時、議長をされていた高久史麿先生に、研究のゲノム解析に基づく科学的根拠や試験の目的について高く評価していただきました。
関連部署
企画調整室 / 調整事務局
渉外(契約・治験薬)
医師主導治験では、企業から治験薬と安全性情報を提供いただくことが必要です。また、製造販売業者しか臨床試験のデータを使用した承認申請ができないため、企業との連携が不可欠です。しかし、承認され、後発医薬品が発売されている医薬品について、企業から協力をいただくことは多くの課題があります。このような状況で、臨床試験部長およびスタッフが研究者と共にノバルティスファーマを訪問し、開発の意義・必要性をプレゼンした結果、研究実施のための契約(治験薬無償提供および安全性情報の提供)を締結することができました。
関連部署
企画調整室 / 調整事務局
手順書整備
各実施医療機関において、バラつきのない均一なデータを収集し、品質の高い治験を実施するためには、同一の手順で実施すること、つまり手順書の作成が不可欠です。医師主導治験では、治験責任医師が、治験実施計画書の作成、治験使用薬の管理など治験の実施の準備及び管理に関する業務の手順書を作成しなければなりません(医薬品GCP第15の2)。KAICA Trialをはじめ、臨床試験部が支援する医師主導治験では、治験に必要な手順書の提供及び作成支援を行っています。KAICA Trialでは約40もの手順書を基に治験が実施されました。
関連部署
企画調整室 / 調整事務局 モニタリング室 データマネジメント室 生物統計室 CRC室
IRB申請
治験計画届出
治験の実施を国から認めてもらうために、医薬品医療機器総合機構(PMDA)へ治験計画届を提出し、PMDAの調査(30日又は14日)を受ける必要があります。医師主導治験では、企業治験とは異なり、IRBの承認後に治験計画届を提出します。
関連部署
企画調整室 / 調整事務局
実施中
CRC支援
被験者の組み入れの際には、リクルートの支援、スクリーニングの補助(適格、除外基準の確認)、併用薬のチェック(併用禁止薬はないかの確認)等を行いました。
治験責任医師から被験者候補の方に同意説明の際に、同意補助説明を行いました。
診察時には検査の補助やその他、治験の円滑な実施のため、入院、画像検査、薬剤部等との院内調整や医事課の医療費の調整も行いました。
関連部署
CRC室
進捗管理
治験調整医師と臨床試験部のスタッフで、治験の立ち上げ前から終了時まで継続的に進捗会議を実施しました。
- 立ち上げ時:
試験のデザインや評価項目の妥当性、安全性情報の収集に関する討議を実施しました。 - 実施中:
定期会議を実施し、治験運用上の課題を中心に、調整医師、臨床試験部の各部門からの提言がなされ、治験進捗する上での疑義事項を解決しました。定期会議以外にも効果・安全性評価委員会、中央画像判定委員会を開催しました。 - 終了時:
データ固定から統計部門による解析、論文投稿を支援しました。また、本治験参加者のデータシェアリングのため、データ開示や追加解析の重要性に関して意見聴取を行いました。
関連部署
企画調整室 / 調整事務局 モニタリング室
登録推進
以下の3つの施策を実施し、症例登録数の増加に繋げました。
- 情報共有ツールの活用:
治験期間中から解析結果が出るまで、全体の進捗状況や注意点周知の他、登録が順調な施設にインタビューから得られた組み入れのポイントなどを共有するNews Letterを継続的に発行しました。 - 地域治験ネットワークの組織化:
治験実施施設と川崎病患者の多い施設間での治験ネットワークを地域ごとに構築しました。さらに候補患者を確実に組み入れに繋げるため、紹介元施設にもプロトコルの選択基準、除外基準を説明しました。 - 日本川崎病学会に合わせたInvestigator Meetingの開催:
学会参加者に対して川崎病患者の治療方針、患者数の調査を行い、候補患者の多い施設に関して被験者紹介のアプローチを実施しました。また、同学会にて施設の被験者登録状況、治療成績に関する発表を行いました。
関連部署
企画調整室 / 調整事務局 モニタリング室
約10名のモニターが全国22施設を訪問し、参加ドクターがひとつになって研究を行えるよう環境整備に注力しました。
関連部署
モニタリング室
監査
監査業務は外部CROに依頼し、臨床試験部の手順書に従い実施されました。外部CROとのやり取りは、主に治験調整事務局およびモニタリング部門が対応しました。実施前には監査計画書作成に必要な情報提供の他、調査施設の選定や日程調整を行いました。実際の施設調査では、外部CROとの調査範囲の調整や調査対象施設の監査対応支援を行いました。監査の実施後は、指摘事項に対する回答作成を支援しました。
関連部署
企画調整室 / 調整事務局
安全性評価
文献学会報告など各種情報源から収集した安全性情報を一次評価し、PMDAへ提出する報告書の作成を支援しました。
関連部署
企画調整室 / 調整事務局 CRC室
データ管理
eCRFで収集したデータについて、データクリーニングを行い、データの品質管理を行いました。主要評価項目である冠動脈病変(心エコーデータ)は、中央判定を実施していたため、マニュアルや手順書を作成し、それらに基づきデータの管理を行いました。また、小児を対象とした試験であったため、臨床検査値の施設基準値の管理・確認には注力しました。
関連部署
データマネジメント室
中央判定
主要評価項目の冠動脈病変は、心エコー法により測定し、盲検化した上でイベント判定委員会(小児循環器専門医3名)により中央判定を行いました。
関連部署
データマネジメント室
研究会
治験開始前に、主要評価項目にあたる心エコー画像撮影のポイントを周知し、施設間の撮影手技によるバラつきを最小限にすることを目的として研究会を計画しました。参加施設の治験責任医師、治験分担医師、CRC、検査スタッフ等に参加いただき、画像判定委員から心エコー画像撮影の留意点に関して講演いただきました。研究会では小児ボランティアを募集し、実技として研究者自ら撮影をしました。
治験実施中は日本川崎病学会の開催に合わせてInvestigator Meetingを定期的に開催し、進捗状況の共有や治験における注意点の周知、症例組み入れに繋がるポイントの紹介を行い、研究者のモチベーションの維持に努めました。
関連部署
企画調整室 / 調整事務局 モニタリング室 データマネジメント室 生物統計室 CRC室
終了時
症例検討会
逸脱例の症例の解析上の取扱い基準の適切性について、治験調整委員へ確認することを目的として開催されました。治験調整医師やその他のプロジェクトメンバーによる協議によって症例の取扱いを決定しました。
関連部署
データマネジメント室
データ固定
統計解析
生物統計の専門家が治験で収集したデータを解析しました。
関連部署
生物統計室
総括報告書作成
総括報告書は、治験の目的・デザインから統計解析のデータおよび有効性安全性の考察まで治験のあらゆる情報を詳細にまとめた報告書であり、治験の終了(中止)後に作成することが求められています(医薬品GCP第26条の11)。内容を充実させる必要があること、また高度なメディカルライティングスキルを要することから、臨床試験部が支援する医師主導治験では、原則、総括報告書の作成を企業へ外部委託しています。KAICA Trialにおいては、委託業者選定・業務委託契約の締結、総括報告書作成にあたっての資料提供、及び作成された総括報告書(案)のレビュー(数回)まで支援を行いました。特に、原本はノバルティスファーマ社 スイス本社から薬事申請の了解を得るため英語版とし、その日本語翻訳版も作成し案の段階からレビュー含め支援しました。
関連部署
企画調整室 / 調整事務局 生物統計室
PMDAからの実地調査
2019年8月にPMDA信頼性保証部による調査が行われました。
- GCP実地調査
症例報告書と実施医療機関の原資料情報の精査、保管文書の品質調査が行われました。必要資料の準備の他、モニタリング部門では調査対象施設のスタッフと協力し、調査実施前に情報整理を行いました。 - 適合性書面調査
予め定められた手順書に従い治験が実施されているかといった観点から調査がなされました。規定がない場合の運用方法に関しても照会がありましたが、治験実施中から運用上の決め事の一覧表を作成していたことで、適切に対応することができました。
関連部署
企画調整室 / 調整事務局 生物統計室


