プロトコル評価専門部会(PRC)
倫理審査を必要とする臨床試験(介入試験等)に関して、科学的および倫理的観点から専門的な評価を倫理審査前に実施することで、より質の高い研究が実施されることを目的とし、臨床研究基盤整備推進・管理委員会のもとに設置しました。
該当する臨床研究
附属病院の臨床研究倫理審査委員会、認定臨床研究審査委員会(特定臨床研究など)、および千葉大学主導の医師主導治験は、PRCで合意を得る必要があります。
PRC実施の流れ
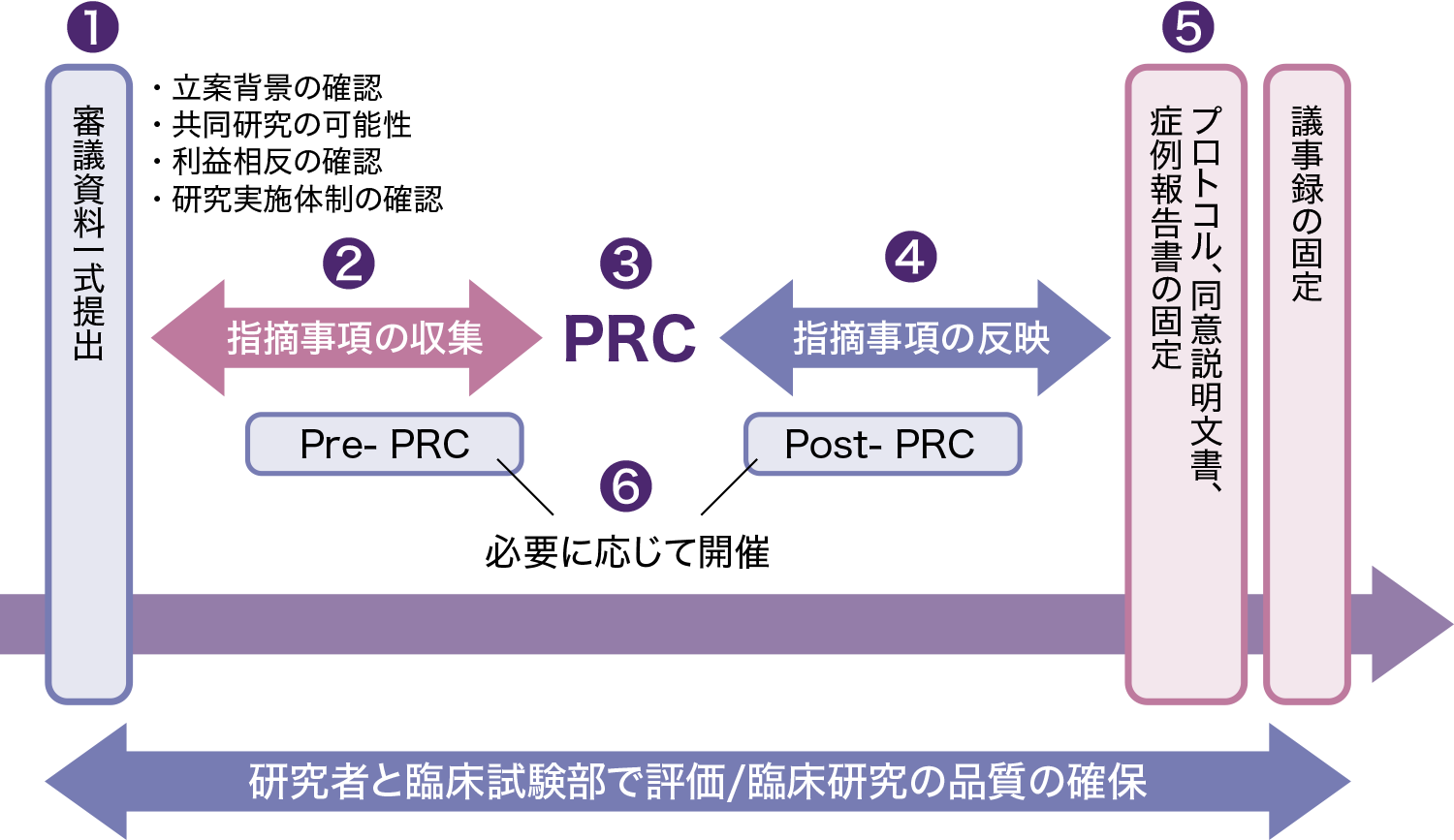
- 臨床研究を実施しようとする研究者は、PRC審議資料(実施計画書・同意説明文書、症例報告書など)を作成し、試験管理室に提出する。
正確な PRC 審議資料は試験の内容に応じて各倫理審査委員会のウェブページからご確認ください - PRC審議資料に関する指摘事項を、PRC委員のレビューにより収集する
例)先行研究との関連性、評価項目・目標症例数等の設定に関する統計的根拠、
同意説明文書におけるあいまいな記述等 - PRCが開催され、指摘事項について研究者とPRC委員の間で協議を行う
- PRCにおける協議の結果を、研究者がPRC審議資料に反映する
- PRCの結果が反映された実施計画書・同意説明文書・省令報告書及びPRC議事録が固定・承認される
- 研究者へのフォローアップのために、必要に応じてPRCの前後でPre-PRCおよびPost-PRCが開かれる場合がある
審議事項
- 試験計画作成の妥当性の評価
- 同意説明文書作成の妥当性の評価
- 症例報告書作成の妥当性の評価
- PRCにおける協議の結果を、研究者がPRC審議資料に反映する
- その他臨床試験実施に必要な事項の評価
構成する委員
- 臨床試験部長
- 臨床試験企画専門家
- 1名
- 医学専門家
- 1名
- 医薬統計専門家
- 1名以上
- 薬事専門家
- 1名以上
- CRC専門家
- 1名以上
- 臨床薬理学、
薬物動態学専門家 - 1名
- 治験審査委員会が
指名した専門家 - 1名
- その他
部会が必要と認めた者

