利益相反管理・確認
利益相反(COI)とは
COIとは、企業など営利団体から資金や役務、研究に使用する医薬品等が提供されて実施する研究の結果が、提供元にとって有利あるいは不利になる可能性がある場合に、公正であるべき研究結果の判断に影響をもたらしかねないと第三者から見て懸念される状況を指します。そのため、研究を実施するにあたって、事前にCOIの確認・管理が必須となります。
以下の際に、COI管理・確認の手続きが必要となります。
- 研究を開始するとき
- 責任医師、統計解析責任者、分担医師、または研究実施によって利益を得る事が明白な者が追加または変更されるとき
- 定期報告を行うとき(既に一度手続きを行っていても、再度定期報告時に確認する必要があります)
- 申告内容に変更があるとき(研究に関連する企業の追加、資金の変更等)
COI管理・確認の手続きに関する詳細は、こちらをご確認ください。
※令和7年5月31日より、COI管理の主体が研究代表医師(単施設の場合研究責任医師)から統括管理者に変更されました。また、法人及び団体が統括管理者となることが認められました。各施設で作成された利益相反管理基準(様式E)は統括管理者へ提出をお願いいたします。
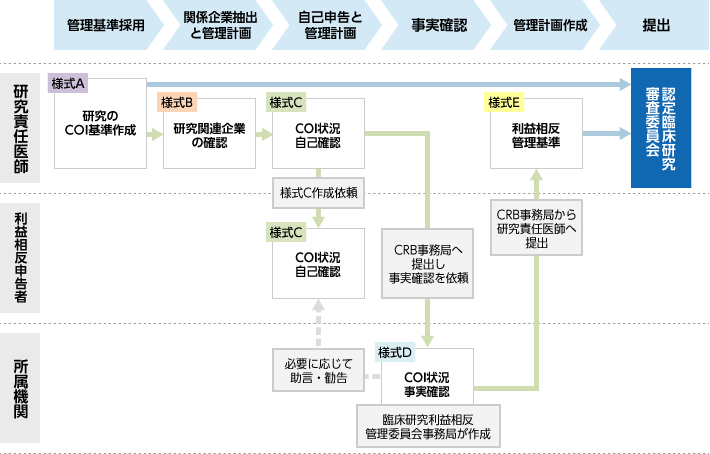
COI管理・確認の流れ -単施設研究の場合-
研究責任医師は利益相反管理ガイダンスの様式の様式A~Cを作成し、CRB事務局(prc-jim(アットマーク)chiba-u.jp)にご提出ください(様式DとEは削除せずにご提出ください)。
様式Cは利益相反申告者(研究責任医師、分担医師、統計解析責任者等)1名につきひとつのExcelシートをご作成ください。
その後、CRB事務局から臨床研究利益相反管理委員会事務局を通じて、当院の研究推進課に実際の企業からの資金の受け取り状況の確認(事実確認)を依頼します。この確認が終了後、様式Dを記入して返送しますので、様式A~Dをご確認いただき、問題なければ様式Eを作成して再度CRB事務局へご提出ください。
COI管理・確認の詳細な手続きに関しては、こちらをご覧ください。
※画像をクリックで拡大します
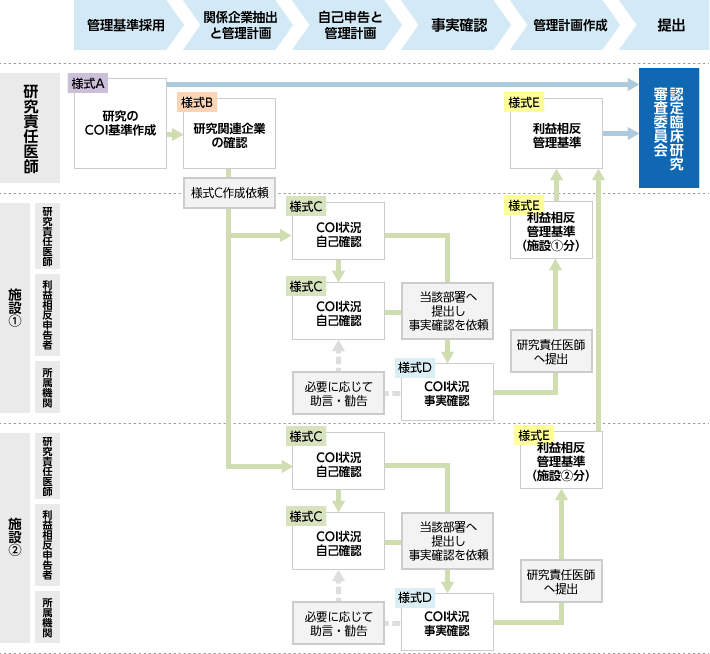
COI管理・確認の流れ -多施設共同研究の場合-
研究代表医師は利益相反管理ガイダンスの様式の様式A、Bを作成し、各施設の研究責任医師へそれぞれの施設の様式Cの作成を依頼します。様式Cは利益相反申告者(研究責任医師、分担医師、統計解析責任者等)1名につきひとつのExcelシートをご作成ください。
様式Cを作成後、各施設の研究責任医師は、各々の当該部署へ事実確認を依頼します。当院に関する利益相反は、CRB事務局(prc-jim(アットマーク)chiba-u.jp)にご提出ください。
この確認が終了後、各施設の責任医師は様式A~Dを確認し、問題がなければ様式Eを作成して研究代表医師へ提出します。その後、研究代表医師はすべての施設のCOI書類をCRBへ提出します。当院CRBを利用する場合には、CRB事務局(prc-jim(アットマーク)chiba-u.jp)にご提出ください。
COI管理・確認の詳細な手続きに関しては、こちらをご覧ください。
※画像をクリックすると拡大します
COI管理・確認書類の各様式について
(臨床研究法における臨床研究の利益相反管理について医政研発1130第17号)
役割・作成方法
COI管理・確認書類の各様式の役割と作成方法を以下に記載します。なお、COI管理・確認書類の各様式を作成する際には、利益相反管理ガイダンスの様式をご使用ください。
この各様式にはマクロ機能があるため、コンテンツを有効化して【様式A】から順番に記入していくと共通の項目内容が自動的に生成されます。
様式A
研究責任医師(多施設共同研究の場合には研究代表医師)は、利益相反管理基準を作成します。【様式A】シートの黄色及び水色で塗りつぶされているセルをご記入ください。
様式B
研究責任医師(多施設共同研究の場合には研究代表医師)は、研究への企業の関与の内容を確定し、利益相反管理基準に基づき当該研究への企業の関与に関する利益相反管理計画を作成します。【様式B】シートの黄色及び水色で塗りつぶされているセルをご記入ください。
様式C
研究責任医師は自身の個人収入等の申告書を作成し、その他の利益相反申告者(分担医師、統計解析責任者等)に個人収入等の申告書の作成を依頼します。様式Cは利益相反申告者1名につきひとつのExcelシートをご作成ください。
初めに、【様式C_研究責任医師】シートに日付、所属機関、立場、氏名を記載し、「研究利益相反自己申告書(様式C)が必要なもの」の欄に、利益相反申告者の立場と氏名をご記入ください。その後、研究責任医師に関する「2.本研究の各対象薬剤製薬企業等との利益相反報告」をご記入ください。
同様に、分担医師、統計解析責任者等1名につきひとつの【様式C】シートの作成し、日付、所属機関、立場、氏名を記載して、「2.本研究の各対象薬剤製薬企業等との利益相反報告」をご記入ください。
当院では、様式A, B, Cが完成したら、CRB事務局(prc-jim(アットマーク)chiba-u.jp)に【様式A~E】の書類をご提出ください。
様式D
所属機関は、提出された申告内容に関係する事実確認を行い、必要に応じて申告者に助言・指導を行った上で、最終的な確認結果を研究責任医師に提供します。
当院では、CRB事務局に書類を提出いただければ、臨床研究利益相反管理委員会事務局から研究推進課に事実確認が依頼されます。この事実確認が終了後、臨床研究利益相反管理委員会事務局より様式Dを記載して返送します。
様式E
責任医師は、上記で返送された【様式A】、【様式B】及び【様式D】の内容をご確認ください。【様式E】シートに日付、所属機関、立場、氏名を記載し、様式A~Dに問題がなければ、本研究に関与する対象薬剤製薬企業等との利益相反管理計画に、「申告すべき利益相反がないことを確認しました。」をプルダウンリストからご選択ください。申告すべき利益相反がある場合、該当する内容を記載してください。
以上の手続きがすべて終了しましたら、再度【様式A~E】の書類をCRB事務局(prc-jim(アットマーク)chiba-u.jp)にご送付ください。
各様式のまとめ
| 役割 | 作成者 | 内容 | |
|---|---|---|---|
| 様式A | 利益相反管理 基準の設定 |
研究責任(代表)医師 |
|
| 様式B | 関連企業の報告 | 研究責任(代表)医師 | 研究に関係する企業との関わりの内容について整理するもの |
| 様式C | 研究者の 利益相反 の自己申告 |
|
様式BのQ1に該当する企業(研究対象薬剤等を製造販売する企業)とのCOIの内容と管理計画を記載する |
| 様式D | 利益相反の 状況確認 |
様式Cの作成者の所属機関 | 様式Cの内容の正確性を、所属機関が把握している情報を元に確認が行われる |
| 様式E | 利益相反 管理計画 |
研究責任(代表)医師 |
|
※様式C・Dは企業等が製造販売等する薬剤等を対象とする場合のみ必要
申請者の方へ
Copyright © 千葉大学 認定臨床研究審査委員会. All Rights Reserved.