特定臨床研究とは
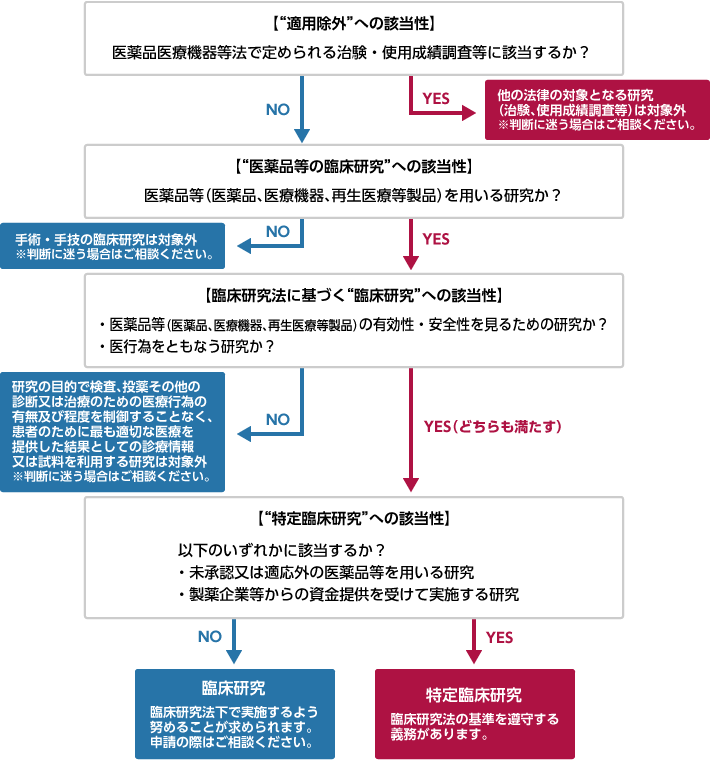
立案中の研究が臨床研究法で定められる特定臨床研究に該当するかどうか、下記のフローチャートでご確認いただけます。また、「臨床研究法の対象となる臨床研究等の事例集について(その1) 」(厚生労働省医政局研究開発振興課,平成30年10月16日)の内容をこちらにまとめておりますので、ご参照ください。
- ご相談の連絡先
- 認定臨床研究審査委員会事務局
- TEL:043-226-2616(平日8:30~17:15)
Mail:prc-jim〔アットマーク〕chiba-u.jp
“臨床研究”とは、臨床研究法第2条1項において「医薬品等を人に対して用いることにより※1 、当該医薬品等の有効性又は安全性を明らかにする※2研究」であると定義されています。
- ※1
- 医薬品等を人に対して投与・使用する行為のうち、医行為に該当するもの。
医行為とは
医師の医学的判断及び技術を持ってするのでなければ、人に危害を及ぼし、又は及ぼす恐れがある行為
(例)医療機器を用いて体温の計測のみを行なう研究は医行為に該当しないが、患者の疾患該当性等について診断を行う場合は該当する。 - ※2
- 有効性・安全性を明らかにする目的での、医薬品等の投与・使用(医行為)のこと。
通常の診療行為を行ないその経過や結果等について評価を行なう、いわゆる観察研究は法に基づく臨床研究には該当しない。
“特定臨床研究”は、臨床研究のうち
- 医薬品等製造販業者又はその特殊関係者から研究資金等の提供を受けて実施する臨床研究
または - 未承認又は適応外の医薬品等を用いて実施する臨床研究
のいずれかを満たすものと定められ、臨床研究法の基準を遵守する義務が課せられます。
臨床研究法の対象外となる研究については省令で規定されており、
- 研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、患者のために最も適切な医療を提供した結果としての診療情報又は試料を利用する研究
- 治験
- 医薬品の製造販売後調査等のうち再評価に係るもの
- 医療機器の製造販売後調査等のうち使用成績評価に係るもの
- 再生医療等製品の製造販売後調査等のうち使用成績評価、再評価に係るもの
- 適合性に関する情報収集のために行なう試験
が該当します。
また、特定臨床研究には該当しない臨床研究(例えば既承認薬を用いた臨床研究等)には基準遵守の努力義務が課され、特定臨床研究に準じた取扱いが求められます。
認定臨床研究審査委員会
について
Copyright © 千葉大学 認定臨床研究審査委員会. All Rights Reserved.