近年、脂肪の過剰摂取など食事の欧米化・晩婚化・出産回数の低下などライフスタイルの変化に伴い、日本の子宮体がんの患者さんは年々増加して、20年前に比べ5倍ほどになっています。それに伴い、子宮温存を希望する患者さんの数も増加傾向にあります。
子宮体がんの標準治療は手術療法(子宮摘出)ですが、初期に発見され、転移などが無い患者さんの場合は、メドロキシプロゲステロン(MPA)という内服薬での子宮温存療法が可能です。
子宮温存療法では、メドロキシプロゲステロン(MPA)を6か月~9か月程度服用し、定期的に内膜の検査を行い寛解したかどうかを判定します。この治療を行った患者さんのうち、8割程度は寛解(組織診断を行って、がん細胞が完全に消失した状態)します。しかしながら、寛解した方の約半数はその後数年で再発するといわれており、再発した場合には子宮を摘出せざるを得ない場合もあります。
そこで千葉大学では2009年から2014年まで、子宮内膜異型増殖症・子宮体がん(IA)の患者さんに対し、メドロキシプロゲステロン(MPA)とメトホルミンを組み合わせた新しい子宮温存療法の効果と安全性を検討するための臨床研究を行いました。その結果、メドロキシプロゲステロン(MPA)のみ服用した患者さんよりも、メドロキシプロゲステロン(MPA)とメトホルミンの両方を服用した患者さんのほうが、再発率が低い可能性があることが示されました。
しかし、メドロキシプロゲステロン(MPA)とメトホルミンを組み合わせた治療法において、メトホルミンをどのくらい服用するのが最も良いのか、また長期にメトホルミンを服用した際の有効性と安全性はどうか、という点はまだ十分には分かっていません。そこで、私たちは、医師主導治験を実施し、それらを明らかにすることとしました。
Mitsuhashi A et al. A phase II study of medroxyprogesterone acetate plus metformin as fertility-sparing treatment for atypical endometrial hyperplasia and endometrial cancer. Ann Oncol 2016; 27:262-266.
本治験は、子宮温存を希望する子宮内膜異型増殖症及びIA期子宮体がんの患者さんに対し、メドロキシプロゲステロン(MPA)にメトホルミンを併用する新規治療法での、メトホルミンの適切な投与量を調べることを主目的としています。メドロキシプロゲステロン(MPA)にメトホルミンを併用する治療法の有効性を、治験開始から3年経過した時点の再発割合を比較して評価します。また、同時にメトホルミンの安全性も評価し、有効性と安全性からメトホルミンの最も適切な投与量を決定します。
本治験によりメトホルミンの適切な用量が明らかになり、従来の子宮温存療法に比べ再発が少ないなど効果が認められれば、メトホルミンを通常診療で患者さんに投与することができるようになります。
子宮温存療法の治療成績を改善することは、妊娠を望む子宮体がんの患者さんにとって、非常にメリットが大きいと考えられます。
本治験は、約3年で138名の患者さんを集め、A群、B群、C群のいずれかに割り当てます。どの群になるかは、患者さんも、私たち医師も事前に知ることはできません。
A群に割り当てられた患者さんはメドロキシプロゲステロン(MPA)のみ、B群に割り当てられた患者さんはメドロキシプロゲステロン(MPA)に加えメトホルミンを750mg、C群に割り当てられた患者さんはメドロキシプロゲステロン(MPA)に加えメトホルミンを1,500mg、服用します。
第I期は4週毎に来院し、規定の検査を受けていただきます。
36週間の時点で病変が消失した場合のみ、第II期に移行し治験を継続していただきます。
第II期では、B群の患者さんはメトホルミン750mg、C群の患者さんはメトホルミン1,500mgを服用します。妊娠を希望しない場合には、いずれの群の患者さんも月経コントロールを行います。
出産もしくは中止基準に該当しない限り、この治験が終了する2025年5月頃まで治験を継続していただきます。

今回の治験では、次の全ての事項に該当する患者さんにご参加をお願いしています。
一方、次のいずれかの事項に該当する患者さんはご参加いただけません。
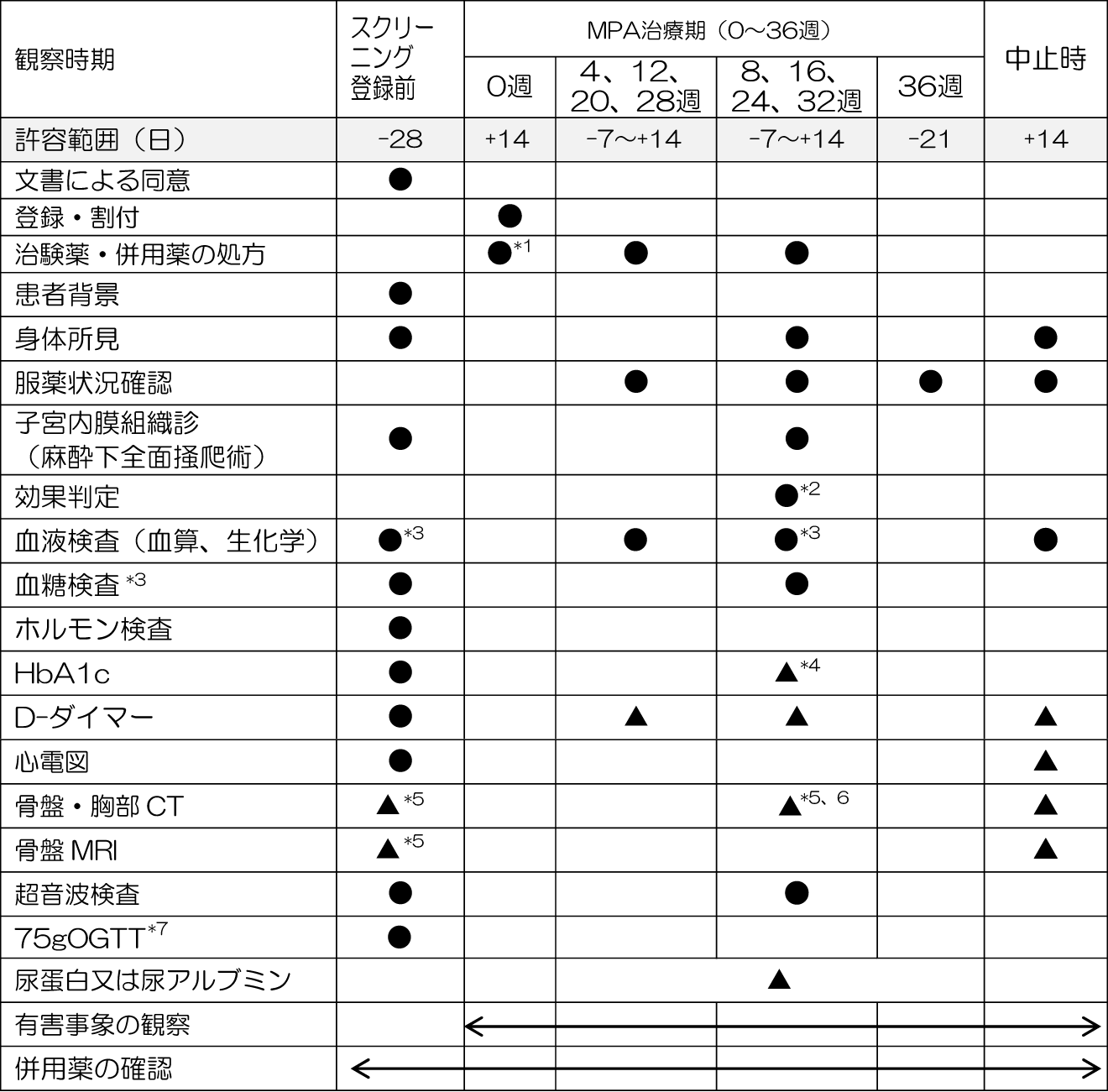
●:必須の検査項目 ▲:必要に応じて実施する検査項目

●:必須の検査項目 ▲:必要に応じて実施する検査項目
本治験に参加している間は、以下の薬剤、治療法を併用することはできません。