TR研究―粘膜ワクチンへの応用
我々は、的確な抗原デリバリーシステムやアジュバントを併用した経口・経鼻免疫により、注射型投与では誘導困難である抗原特異的粘膜免疫応答(例、分泌型IgA)が誘導出来ることを実証し、さらに注射型と同様に抗原特異的全身免疫(例、血清IgG)も誘導出来ることを示す基盤形成に貢献してきました(1-3)。このように、経口・経鼻免疫によりに粘膜面と体内に効果的な抗原特異的免疫応答を惹起し、二段構えの防御を確立することが出来ることを踏まえて、2003年からは、感染症に対する次世代ワクチンとして期待されている「粘膜ワクチン」の開発へ向けて革新的研究を先導し、腸管免疫と呼吸器免疫機構のユニーク性を駆使した経口ワクチンと経鼻ワクチンの開発研究を進めています(4, 5)。
呼吸器感染症に対する経鼻ワクチン
2019年に発生した新型コロナウイルス感染症(COVID-19)は、SARSコロナウイルス2 (SARS-CoV-2) がヒトに感染することによって発症する感染症で、発熱、咳、のどの痛み、倦怠感などの症状を引き起こし、症例によっては肺炎、呼吸困難、呼吸不全など命に関わる重篤な症状を引き起こすことがあります。また、一部の患者には混乱状態、昏睡、意識消失、脳の炎症や心臓や血管へ影響も報告されています。インフルエンザは悪寒、高熱、頭痛、全身倦怠感、筋肉痛を特徴とする、気道炎症状や胃腸症状を引き越し、症例によっては肺炎、呼吸不全、脳症など重篤な症状を呈し、命に関わる場合があります。
人類はこれまでにインフルエンザやCOVID-19の世界的流行により医療機関のひっ迫や社会機能の停止を経験してきました。我々は感染症の脅威からの解放を重要課題として取り組んでいる塩野義製薬と共同で呼吸器感染症に対する経鼻ワクチンの研究開発を進めています。
カチオン化ナノゲル経鼻ワクチン
「経鼻ワクチン」開発に向けて、呼吸器の粘膜上皮層が負に帯電していることに着目し、マテリアル工学領域研究と連携し、蛋白質を内包する特性を持つ疎水化水溶性高分子コレステロール置換プルランをカチオン化する事で、連携し、蛋白融合・内包能を有する疎水化高分子コレステロール置換プルランをカチオン化する事で、上皮細胞への粘膜付着性を向上させたカチオン化ナノゲル(cCHP)経鼻ワクチンデリバリー技術を開発しました(6)。ワクチン抗原は、疎水性相互作用によりcCHPナノゲルに封入され、経鼻投与後に鼻咽頭関連組織(NALT)に加えて、副鼻腔上皮細胞層に長時間付着し、endocytosisにより鼻腔粘膜上皮細胞に取り込まれて、上皮細胞内で抗原はナノゲルから遊離し、exocytosisにより、基底膜を通過し、その直下に集積してくる樹状細胞に対して徐放性に抗原を送達し、呼吸器粘膜免疫機構を介して、効果的に抗原特異的免疫応答を誘導することを確認しました(6-10)。
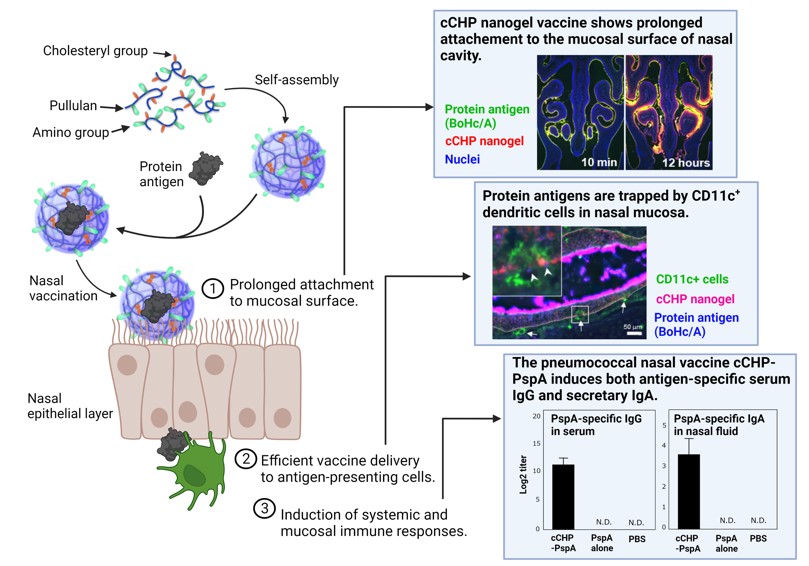
次に、cCHPを駆使して、呼吸器感染症として重要な肺炎球菌に対しての経鼻ワクチン開発を進めています。現行の肺炎球菌流行株の糖鎖抗原を使った注射型多価ワクチンは、重症化を防ぐことは出来るが、感染阻止効果は期待出来ません。さらに、100種類の血清型からなる肺炎球菌に対して、現行ワクチンは流行株のみを対象としており、血清型置換による流行株以外の肺炎球菌蔓延が臨床現場では課題となっています。そこで、米国UAB時代からの肺炎球菌共通蛋白抗原PspAを使った粘膜免疫誘導に関する共同研究の成果(11-14)を基盤として、PspAを封入したカチオン化ナノゲル経鼻ワクチン(cCHP-PspA)は、効果的に肺炎球菌侵入阻止効果がある抗原特異的IgA抗体を呼吸器粘膜に誘導することを証明しました(15)。また、下気道には肺炎球菌に対して排除効果のある抗原特異的IgG抗体が誘導されることも確認しました。さらに、ヒトに近い霊長類を用いて、cCHP-PspAの肺炎球菌に対する経鼻ワクチンとしての安全性と有効性を実証すると同時に、浜松ホトニクス社の共同研究によりタンパク質PET法を開発し、ナノゲル経鼻ワクチンの霊長類で脳・嗅球を含む中央神経系へのワクチン挙動を解析してナノゲルDDSの安全性を証明しました(16, 17)。さらに、3種類のPspAキメラ抗原をcCHPと組み合わせた3価cCHP-PspAは、異なる血清型の肺炎球菌に対する広範な交叉性免疫誘導能があることを示すとともに、霊長類を用いた免疫・感染実験により、その肺炎発症予防効果を確認しました(18)。肺炎球菌に加えて、中耳炎の原因菌として知られている、インフルエンザ菌のP6抗原を用いたcCHP-P6製剤を用いた中耳炎ワ経鼻ワクチンの開発にも成功しています(19)。他の呼吸器感染症(例、RSV、Influenza、SARS-CoV-2)に対しても、経鼻ワクチン研究開発が進んでいます。この技術を基盤として、大学発ベンチャーHanaVax社を立ち上げ、経鼻ワクチンの具現化に向けての産学共同研究を進めています。
コメ型経口ワクチンMucoRice
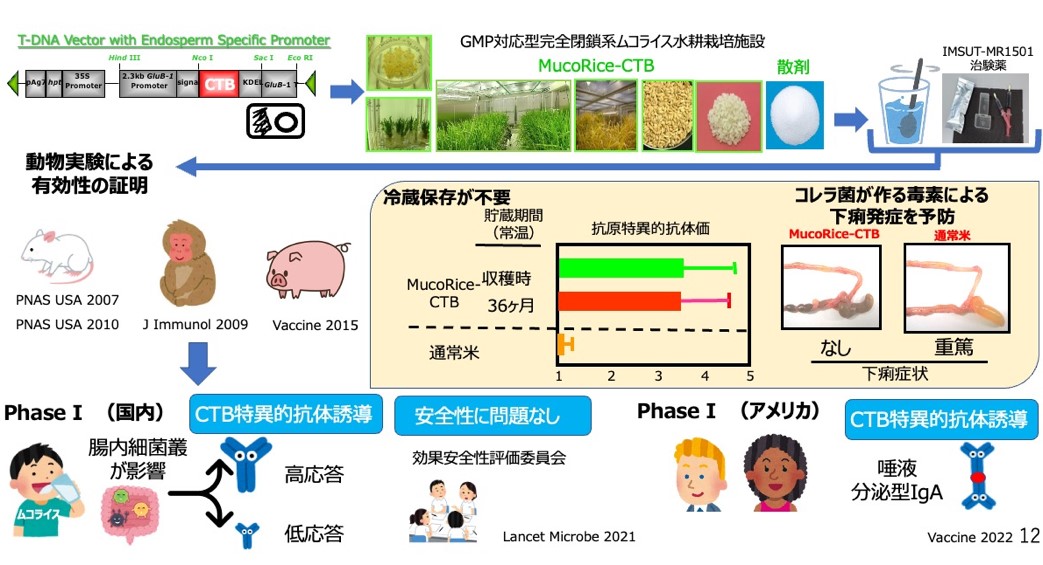
ワクチンが必要とされている社会インフラが整っていない開発途上国での大きな課題であるワクチンの冷蔵・冷凍保存(コールドチェーン)の必要性を回避し、常温で長期保存可能な「冷蔵・冷凍保存と注射器・注射針が不要なワクチン」の開発です。コメ型経口ワクチンMucoRiceシステムは、イネ種子にワクチン抗原を発現・生産・保存させる技術であり、農学系と工学系(植物工場)との融合研究で、常温安定備蓄型経口ワクチンを可能にしました(20)。現在でも開発途上国を中心として問題となっている腸管感染症の一つであるコレラ菌による腸管下痢症(毎年10-15万人が重篤な下痢症により死亡)や旅行者下痢症の予防を対象とした予防に向けて、MucoRiceシステムにコレラ毒素(CT)の無毒性B鎖(CTB)抗原を発現させたMucoRice-CTBの開発に着手しました。MucoRice-CTBはコメの胚乳細胞にワクチン抗原を発現させることで、常温で安定な蛋白生産・保存できる技術として確立し、それをコレラに代表される腸管感染症に対するワクチン生産と経口投与法として応用し、室温安定備蓄型経口ワクチンの開発を可能にしました (20, 21)。MucoRice-CTBは実験用小動物(マウス)から大動物(ブタ)、そして霊長類において、MucoRice-CTBが経口ワクチンとして毒素中和効果がある抗原特異的IgAとIgG抗体の誘導能があることを証明しました(20-25)。重要な点は、CTBを注射型ワクチンとして投与した場合は抗原特異的血清IgG抗体が誘導されたにもかかわらず、下痢抑制には有効ではないことが直接的に証明され、CTB発現米粉末を経口免疫することで誘導されたCTB特異的分泌型IgAが決定的な役割を果たしていることを、分泌型IgAを構成して粘膜面に誘導できない遺伝子組換えマウスを用いて証明したことにあります(21)。こうして開発されたMucoRice-CTBをヒトへの経口投与を可能とするために、遺伝子組換えイネ作成時に用いる選抜マーカーであるハイグロマイシン耐性遺伝子等を含まない、Marker Free MucoRice-CTB51Aを作出に成功し(26)、種子バンクを構築いたしました(27, 28)。51A株はイネゲノムにワクチンカセットを含むT-DNAベクターがイネ3番染色体にタンデムに、イネ12番染色体に1コピーに挿入されおり、その全導入遺伝子配列も決定しました(26)。遺伝子組換え米としての安全性評価としてプロテオーム及び植物組織学的解析を行い51A株がα-amylase/trypsin inhibitor-like protein familyの発現量がMucoRice-CTBで有意に減少している低アレルゲン米であることも確認しました(29, 30)。東大医科研内に完全閉鎖系の原薬GMP施設を構築し、GMPに対応したMuocRice-CTB経口コレラワクチンを治験薬として製造しました(31)。
非臨床での毒性試験等を実施したのち、日本人健常者男子を対象とする第Ⅰ相臨床治験(Phase I)を、東大医科研附属病院で無作為、プラセボ対照、二重盲検、2週間間隔4回反復投与、用量漸増試験(1、3、6g)をFirst-in-humanとして実施し、ヒトでの安全性と忍容性及び免疫原性を確認しました(32)。本治験では重篤な有害事象は確認されず、抗原特異的抗体誘導(例: IgA・IgG抗体)陽転率は用量漸増に伴い上昇(1g用量:40%, 3g用量:55%, 6g用量:75%)し、ヒトでの経口ワクチンとしての免疫原性を実証することが出来ました。この結果を踏まえて、米国FDAのPre-IND及びINDでの治験申請の下で、AMED CiCLE事業により、米国人健常者男女を対象とした6g用量のみの第IB相臨床治験(Phase IB)が実施され、6gでの安全性、忍容性が米国でも確認され、人種多様的に免疫原性があり、抗原特異的分泌型IgA誘導効果を確認することが出来ました(33)。
経口抗体による腸管感染症の治療法確立

ロタウイルスやノロウイルス感染による下痢症は、発展途上国の子どもおよび免疫不全の患者の生命を脅かす疾患のひとつです。我々は、ロタウイルス特異的に中和能を有するラマ単鎖抗体可変ドメイン(VHH)を発現する遺伝子組換え米(MucoRice-ARP1)を用いて、ロタウイルス疾患に対する新規予防法および治療法を開発しました。ラマ重鎖の VHH 断片は、熱や酸に安定な分子量12KDaの小さなタンパク質で、そのため、VHHは経口免疫療法や腸管感染症予防のための魅力的で有用な抗体となっています。ARP1はロタウイルスのVP6抗原に対するユニバーサル抗体の一つですが、イネ種子におけるARP1は、MucoRiceの特徴であるRNAiによる主要なコメ内在性貯蔵タンパク質の産生抑制システムにより高発現(コメ重量の0.85%)を示しました(34)。MucoRice-ARP1の経口投与は、健常マウスおよび免疫不全マウスのいずれにおいてもロタウイルス誘導下痢を顕著に抑制しました。また、MucoRice-ARP1は長期保存や加熱に対しても安定性が高く、94℃、30分の加熱処理を加えた後でもマウスにおいてロタウイルスに対する防御作用を示しました(34)。この技術を応用して、現在世界的な流行株であるノロウイルスGII.4型と日本を含む東南アジアでの流行株であるGII.17型の其々に対するVHH(7C6および1E4)及びそのヘテロダイマー抗体(7C6と1E4)を樹立しました(35)。ヘテロダイマー抗体を発現するMucoRice-VHH(7C6-1E4)は、ヒトiPS細胞から誘導されたオルガノイドからの腸管上皮細胞を使った培養系でGII.4型とGII.17型ノロウイルス両者を中和できることを確認し、またその高い熱安定性(90℃)も示しました(36, 37)。
経粘膜ワクチンシステムへの利用を目指した機能性高分子ナノ材料の開発
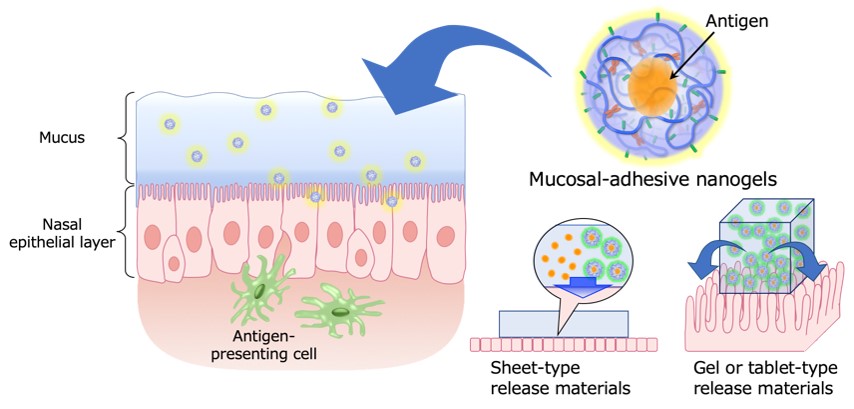
粘膜投与型ワクチンにおいて抗原特異的粘膜免疫応答を誘導するには、ワクチン抗原を粘膜上皮層下に存在する抗原提示細胞(樹状細胞、マクロファージ)に送り込むことが必要です。ワクチン抗原単独での経粘膜送達は、粘膜表面に存在する粘液や分解酵素などが障壁となり効率が悪く、ワクチン抗原を保護しつつ粘膜上皮に送達する工夫が必要となっています。前述した「カチオン化ナノゲル経鼻ワクチン」に利用されているカチオン化ナノゲルは、そのナノサイズのゲル微粒子内部にワクチン抗原を保持し、鼻腔粘膜表面にワクチン抗原を滞留させ、抗原および抗原/ナノゲル複合体を徐放・送達することが可能です(6-9)。これまでの知見をもとに、粘膜表層との親和性や粘膜上皮透過能などの機能向上を目指し、カチオン化ナノゲルや新規デリバリーキャリアの設計、開発を進めています。さらには、粘膜ワクチンの新しい投与プラットフォームとして、高分子化学の観点から「貼る」「飲む」ことが可能な粘膜ワクチンワクチン保持・徐放型機能材料の開発と、それらを応用した非侵襲型ワクチン投与システムの構築を目指しています。
基礎研究―粘膜免疫機構の解明
1970年代後半から、その存在すら余り知られていなかった口腔から始まる消化管における粘膜免疫システムのユニーク性の解明に向けた研究を米国アラバマ大学バーミングハム校(UAB)において開始し、現在まで一貫して粘膜免疫の研究を推進しその学問的基盤形成に貢献してきました。その成果は、粘膜ワクチン開発に向けての理論的・技術的基盤に繋がっています。
腸管における粘膜免疫誘導組織の解明
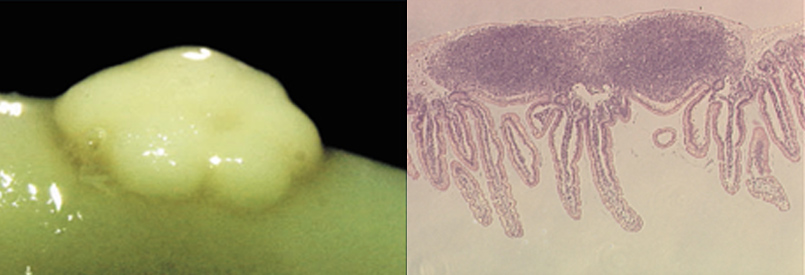
「腸管のパイエル板が抗原特異的免疫応答誘導の場」という仮説の下、現在多用されているパイエル板酵素処理細胞分離法を開発し、それを駆使して同組織に抗原提示細胞が存在することを証明ししました(38)。さらに、IgA応答を選択的に誘導・制御するTh細胞の存在も示し(39, 40)、その後Th2型細胞に分類されました。また、パイエル板に存在するB細胞群の中で微生物依存性 CD11+ IgA B 細胞集団が抗原特異的IgA高産生性を有していることも明らかにしました(41)。これらの成果は、粘膜免疫機構においてパイエル板が抗原特異的免疫応答誘導の場であることを実証し、抗原の注射投与では誘導出来ない粘膜免疫を、経口免疫により誘導出来るメカニズムの理論的基盤形成に繋がりました。さらに、粘膜免疫の中心的な役割を果たすIgA抗体産生とその制御・調節に関するメカニズムを明らかにしてきました(39, 42-46)。さらに、免疫応答の恒常性に欠かせない寛容、特に経口免疫寛容に関しても、そのメカニズムの解析に力をそそぎ、粘膜T細胞やパイエル板の役割とそれらの重要性を明らかにしてきた(47-51)。
粘膜における抗原取り込み機能の解明
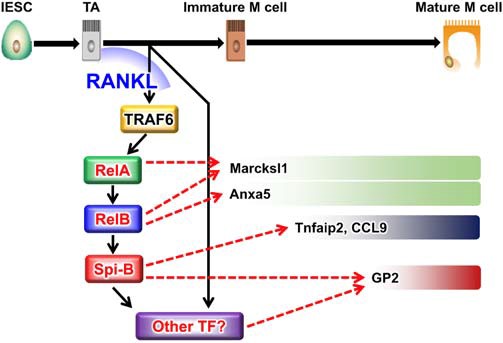
粘膜免疫機構のユニーク性を反映する管腔側からの抗原取り込み機構について、その機能を担う特殊な上皮細胞であるM細胞の解明についても、同細胞膜に特異的に発現する糖鎖修飾抗原認識抗体NKM16-2-4の作製やGP-2の同定に成功し(3, 52, 53)、さらに同細胞の発達と抗原取り込み能を制御する転写因子群Spi-BとAif1 (54, 55)の発見にも貢献しました。さらに粘膜での抗原取り込み機構の中核をなすM細胞は、パイエル板の上皮細胞層だけに存在しているという定説を覆し、絨毛上皮細胞層にも存在することを報告し、「絨毛M細胞」と命名し(56)、粘膜面における抗原取り込み機構の多様性を強く示唆しました。これらの結果は経口免疫による粘膜を介した抗原特異的免疫応答誘導に向けての戦略基盤構築に繋がっています。
腸内細菌叢による粘膜免疫制御
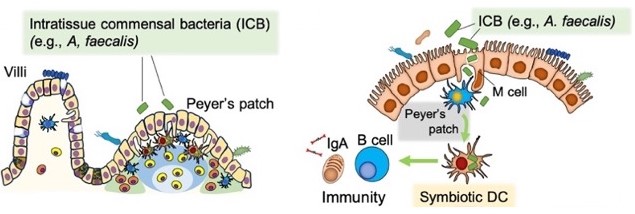
現在注目されている腸内常在菌による免疫機構への影響に関しても、既に1980年に無菌動物を使って同細菌群(例: 大腸菌)またはその由来分子(例: LPS)が、パイエル板を中心とした腸管免疫系の発達・制御に直接的に関わっていることを報告しました(57)。その系譜的研究として、常在菌叢の一部であるAlcaligenes菌がパイエル板内に共生環境を構築していることを世界に先駆けて発見し、「組織内共生」という新しい概念を提唱し(58)、その後、組織内共生環境構築に自然リンパ球3型や樹状細胞が関わっていることも共同研究を通して明らかにしました(59, 60)。最近では、同菌由来のLPSがパイエル板内樹状細胞内での共生や粘膜免疫機構の成熟化に関わり、その化学的構造解析からhexa-acylated lipid AがTLR-4に対する非炎症性粘膜免疫活性化アゴニストとして作用し、IgA誘導に関わっていることを明らかにしました(61, 62)。共同研究を通して、その化学合成品の粘膜アジュバントとしての有効性も確認し(63)、次世代型腸内細菌由来非炎症性アジュバントとして研究開発を進めています。
腸管マルチエコシステムの提唱
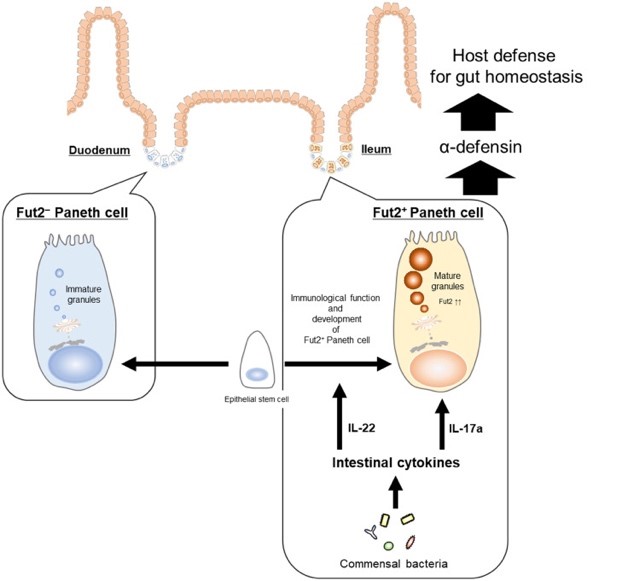
腸内環境において注目されている糖鎖修飾に関して、腸内細菌と自然リンパ球3型がサイトカインIL-22を介して上皮細胞糖鎖修飾を統合的に制御し、病原微生物侵入阻止、共生環境構築に関わっていることを明らかにしました(64-66)。上皮細胞を裏打ちしている間葉系細胞による免疫細胞制御(例: 自然リンパ球とマスト細胞)や、上皮細胞によるバリア機能を制御する機構の存在も示しました(67, 68)。これらの成果は、機能的な粘膜上皮バリア機構に「上皮系―間葉系―免疫系」という宿主構成因子と腸内細菌叢とが協調的にネットワークを形成し機能することの重要性を明示しており、このネットワークを「腸管マルチエコシステム」と提唱しました(69)。さらに、その一翼を担う腸管陰窩に存在する抗菌ペプチド産生細胞であるパネート細胞がその糖鎖修飾により二つのサブセットからなり、特にFut2+パネート細胞が腸管恒常性維持と感染制御に重要な働きをすることを明らかにし、腸管マルチエコシステムにおけるパネート細胞の役割の理解に繋がりました(70)。
呼吸器・眼粘膜免疫機構の解明
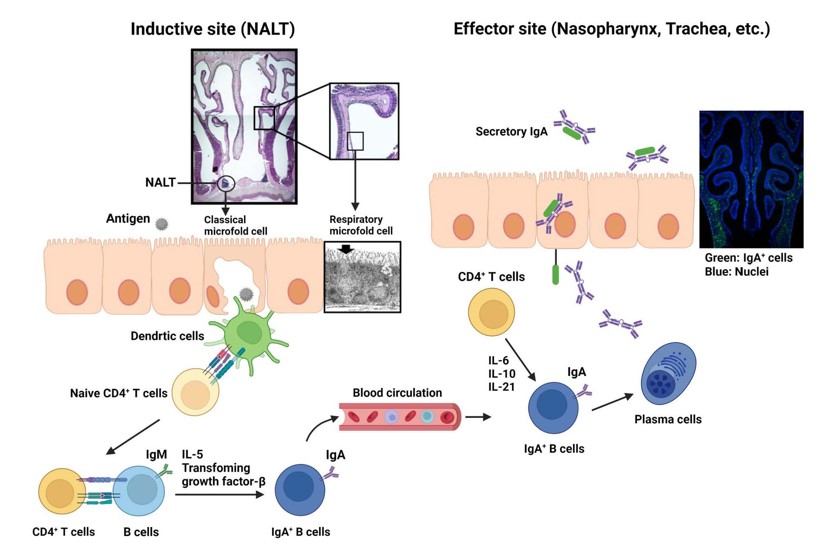
腸管粘膜免疫機構に比較して、未解明であった呼吸器や眼粘膜免疫機構の解明も進め、鼻咽頭関連リンパ組織(NALT)の組織形成プログラムに関与する誘導細胞の同定と分子機構について、パイエル板や末梢リンパ節に代表される他の2次免疫担当リンパ組織形成とは異なることを明らかにしました(49, 50)。さらに鼻腔粘膜において腸管の絨毛M細胞に相当する「呼吸器M細胞」を同定しました(51)。眼領域粘膜免疫機構の要となる涙管関連リンパ組織(TALT)の同定とその組織形成機構に関しても、パイエル板、NALTに次ぐ第3の組織形成プログラムの存在を明らかにしました(52)。これらの研究を通してNALT・TALTが抗原特異的免疫誘応答誘導の場であることが明らになり(50,52)、経鼻・点眼ワクチン開発に向けての基盤形成となりました。
組織特異性と臓器連関性免疫制御機構
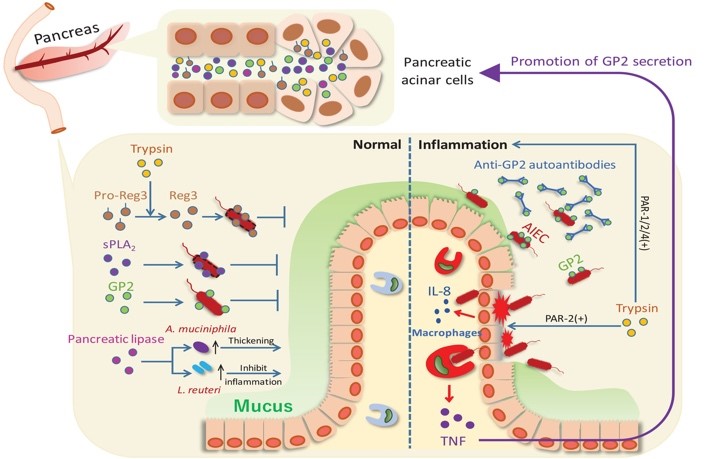
体表面という視点から腸管や皮膚で産生されるATPと同レセプターP2X7を介したマスト細胞制御に関して、組織特異性があることを明らかにしました。腸管ではATP-P2X7カスケードはマスト細胞を介した炎症応答惹起に関わるが、皮膚ではレチノイン酸分解酵素であるcyp26B1によるATP-P2X7カスケードの抑制による過剰応答抑制制御が働いていることを示しました(67, 71)。最近では、膵臓由来糖タンパクGP2を介した膵臓-腸管連関による粘膜恒常性と炎症制御機構が存在することを示しました(72)。これらの成果は組織特異性と臓器連関性免疫制御機構を標的とした新規創薬につながる可能性を秘めています。
これら一連の基礎的研究成果は、粘膜ワクチン開発へ向けての消化器・呼吸器に代表される粘膜免疫機構のユニーク性を基盤とした戦略形成に繋がっています。
<参考文献>
- Kurono Y, Yamamoto M, Fujihashi K, Kodama S, Suzuki M, Mogi G, McGhee JR, Kiyono H. Nasal immunization induces Haemophilus influenzae-specific Th1 and Th2 responses with mucosal IgA and systemic IgG antibodies for protective immunity. J Infect Dis. 1999;180(1):122-132.
- Kweon MN, Yamamoto M, Watanabe F, Tamura S, Van Ginkel FW, Miyauchi A, Takagi H, Takeda Y, Hamabata T, Fujihashi K, McGhee JR, Kiyono H. A nontoxic chimeric enterotoxin adjuvant induces protective immunity in both mucosal and systemic compartments with reduced IgE antibodies. J Infect Dis. 2002;186(9):1261-1269.
- Nochi T, Yuki Y, Matsumura A, Mejima M, Terahara K, Kim DY, Fukuyama S, Iwatsuki-Horimoto K, Kawaoka Y, Kohda T, Kozaki S, Igarashi O, Kiyono H. A novel M cell-specific carbohydrate-targeted mucosal vaccine effectively induces antigen-specific immune responses. J Exp Med. 2007;204(12):2789-2796.
- Azegami T, Yuki Y, Kiyono H. Challenges in mucosal vaccines for the control of infectious diseases. Int Immunol. 2014;26(9):517-528.
- Kiyono H, Yuki Y, Nakahashi-Ouchida R, Fujihashi K. Mucosal vaccines: wisdom from now and then. Int Immunol. 2021;33(12):767-774.
- Nochi T, Yuki Y, Takahashi H, Sawada S, Mejima M, Kohda T, Harada N, Kong IG, Sato A, Kataoka N, Tokuhara D, Kurokawa S, Takahashi Y, Tsukada H, Kozaki S, Akiyoshi K, Kiyono H. Nanogel antigenic protein-delivery system for adjuvant-free intranasal vaccines. Nat Mater. 2010;9(7):572-578.
- Azegami T, Yuki Y, Nakahashi R, Itoh H, Kiyono H. Nanogel-based nasal vaccines for infectious and lifestyle-related diseases. Mol Immunol. 2018;98:19-24.
- Nakahashi-Ouchida R, Yuki Y, Kiyono H. Development of a nanogel-based nasal vaccine as a novel antigen delivery system. Expert Rev Vaccines. 2017;16(12):1231-1240.
- Nakahashi-Ouchida R, Yuki Y, Kiyono H. Cationic pullulan nanogel as a safe and effective nasal vaccine delivery system for respiratory infectious diseases. Hum Vaccin Immunother. 2018;14(9):2189-2193.
- Yuki Y, Uchida Y, Sawada SI, Nakahashi-Ouchida R, Sugiura K, Mori H, Yamanoue T, Machita T, Honma A, Kurokawa S, Mukerji R, Briles DE, Akiyoshi K, Kiyono H. Characterization and specification of a trivalent protein-based pneumococcal vaccine formulation using an adjuvant-free nanogel nasal delivery system. Mol Pharm. 2021;18(4):1582-1592.
- Fukuyama Y, King JD, Kataoka K, Kobayashi R, Gilbert RS, Hollingshead SK, Briles DE, Fujihashi K. A combination of Flt3 ligand cDNA and CpG oligodeoxynucleotide as nasal adjuvant elicits protective secretory-IgA immunity to Streptococcus pneumoniae in aged mice. J Immunol. 2011;186(4):2454-2461.
- Fukuyama Y, King JD, Kataoka K, Kobayashi R, Gilbert RS, Oishi K, Hollingshead SK, Briles DE, Fujihashi K. Secretory-IgA antibodies play an important role in the immunity to Streptococcus pneumoniae. J Immunol. 2010;185(3):1755-1762.
- Yamamoto M, Briles DE, Yamamoto S, Ohmura M, Kiyono H, McGhee JR. A nontoxic adjuvant for mucosal immunity to pneumococcal surface protein A. J Immunol. 1998;161(8):4115-4121.
- Yamamoto M, McDaniel LS, Kawabata K, Briles DE, Jackson RJ, McGhee JR, Kiyono H. Oral immunization with PspA elicits protective humoral immunity against Streptococcus pneumoniae infection. Infect Immun. 1997;65(2):640-644.
- Kong IG, Sato A, Yuki Y, Nochi T, Takahashi H, Sawada S, Mejima M, Kurokawa S, Okada K, Sato S, Briles DE, Kunisawa J, Inoue Y, Yamamoto M, Akiyoshi K, Kiyono H. Nanogel-based PspA intranasal vaccine prevents invasive disease and nasal colonization by Streptococcus pneumoniae. Infect Immun. 2013;81(5):1625-1634.
- Fukuyama Y, Yuki Y, Katakai Y, Harada N, Takahashi H, Takeda S, Mejima M, Joo S, Kurokawa S, Sawada S, Shibata H, Park EJ, Fujihashi K, Briles DE, Yasutomi Y, Tsukada H, Akiyoshi K, Kiyono H. Nanogel-based pneumococcal surface protein A nasal vaccine induces microRNA-associated Th17 cell responses with neutralizing antibodies against Streptococcus pneumoniae in macaques. Mucosal Immunol. 2015;8(5):1144-1153.
- Yuki Y, Nochi T, Harada N, Katakai Y, Shibata H, Mejima M, Kohda T, Tokuhara D, Kurokawa S, Takahashi Y, Ono F, Kozaki S, Terao K, Tsukada H, Kiyono H. In vivo molecular imaging analysis of a nasal vaccine that induces protective immunity against botulism in nonhuman primates. J Immunol. 2010;185(9):5436-5443.
- Nakahashi-Ouchida R, Uchida Y, Yuki Y, Katakai Y, Yamanoue T, Ogawa H, Munesue Y, Nakano N, Hanari K, Miyazaki T, Saito Y, Umemoto S, Sawada SI, Mukerji R, Briles DE, Yasutomi Y, Akiyoshi K, Kiyono H. A nanogel-based trivalent PspA nasal vaccine protects macaques from intratracheal challenge with pneumococci. Vaccine. 2021;39(25):3353-3364.
- Nakahashi-Ouchida R, Mori H, Yuki Y, Umemoto S, Hirano T, Uchida Y, Machita T, Yamanoue T, Sawada SI, Suzuki M, Fujihashi K, Akiyoshi K, Kurono Y, Kiyono H. Induction of mucosal IgA-mediated protective Iimmunity against nontypeable Haemophilus influenzae infection by a cationic nanogel-based P6 nasal vaccine. Front Immunol. 2022;13:819859.
- Nochi T, Takagi H, Yuki Y, Yang L, Masumura T, Mejima M, Nakanishi U, Matsumura A, Uozumi A, Hiroi T, Morita S, Tanaka K, Takaiwa F, Kiyono H. Rice-based mucosal vaccine as a global strategy for cold-chain- and needle-free vaccination. Proc Natl Acad Sci USA. 2007;104(26):10986-10991.
- Tokuhara D, Yuki Y, Nochi T, Kodama T, Mejima M, Kurokawa S, Takahashi Y, Nanno M, Nakanishi U, Takaiwa F, Honda T, Kiyono H. Secretory IgA-mediated protection against V. cholerae and heat-labile enterotoxin-producing enterotoxigenic Escherichia coli by rice-based vaccine. Proc Natl Acad Sci USA. 2010;107(19):8794-8799.
- Nochi T, Yuki Y, Katakai Y, Shibata H, Tokuhara D, Mejima M, Kurokawa S, Takahashi Y, Nakanishi U, Ono F, Mimuro H, Sasakawa C, Takaiwa F, Terao K, Kiyono H. A rice-based oral cholera vaccine induces macaque-specific systemic neutralizing antibodies but does not influence pre-existing intestinal immunity. J Immunol. 2009;183(10):6538-6544.
- Takeyama N, Yuki Y, Tokuhara D, Oroku K, Mejima M, Kurokawa S, Kuroda M, Kodama T, Nagai S, Ueda S, Kiyono H. Oral rice-based vaccine induces passive and active immunity against enterotoxigenic E. coli-mediated diarrhea in pigs. Vaccine. 2015;33(39):5204-5211.
- Yuki Y, Mejima M, Kurokawa S, Hiroiwa T, Takahashi Y, Tokuhara D, Nochi T, Katakai Y, Kuroda M, Takeyama N, Kashima K, Abe M, Chen Y, Nakanishi U, Masumura T, Takeuchi Y, Kozuka-Hata H, Shibata H, Oyama M, Tanaka K, Kiyono H. Induction of toxin-specific neutralizing immunity by molecularly uniform rice-based oral cholera toxin B subunit vaccine without plant-associated sugar modification. Plant Biotechnol J. 2013;11(7):799-808.
- Yuki Y, Tokuhara D, Nochi T, Yasuda H, Mejima M, Kurokawa S, Takahashi Y, Kataoka N, Nakanishi U, Hagiwara Y, Fujihashi K, Takaiwa F, Kiyono H. Oral MucoRice expressing double-mutant cholera toxin A and B subunits induces toxin-specific neutralising immunity. Vaccine. 2009;27(43):5982-5988.
- Mejima M, Kashima K, Kuroda M, Takeyama N, Kurokawa S, Fukuyama Y, Kiyono H, Itoh K, Mitusi T, Yuki Y. Determination of genomic location and structure of the transgenes in marker-free rice-based cholera vaccine by using whole genome resequencing approach. Plant Cell Tiss Org Cult. 2015;120:35-48.
- Kashima K, Mejima M, Kurokawa S, Kuroda M, Kiyono H, Yuki Y. Comparative whole-genome analyses of selection marker-free rice-based cholera toxin B-subunit vaccine lines and wild-type lines. BMC Genomics. 2015;16(1):48.
- Sasou A, Yuki Y, Honma A, Sugiura K, Kashima K, Kozuka-Hata H, Nojima M, Oyama M, Kurokawa S, Maruyama S, Kuroda M, Tanoue S, Takamatsu N, Fujihashi K, Goto E, Kiyono H. Comparative whole-genome and proteomics analyses of the next seed bank and the original master seed bank of MucoRice-CTB 51A line, a rice-based oral cholera vaccine. BMC Genomics. 2021;22(1):59.
- Kurokawa S, Kuroda M, Mejima M, Nakamura R, Takahashi Y, Sagara H, Takeyama N, Satoh S, Kiyono H, Teshima R, Masumura T, Yuki Y. RNAi-mediated suppression of endogenous storage proteins leads to a change in localization of overexpressed cholera toxin B-subunit and the allergen protein RAG2 in rice seeds. Plant Cell Rep. 2014;33(1):75-87.
- Kurokawa S, Nakamura R, Mejima M, Kozuka-Hata H, Kuroda M, Takeyama N, Oyama M, Satoh S, Kiyono H, Masumura T, Teshima R, Yuki Y. MucoRice-cholera toxin B-subunit, a rice-based oral cholera vaccine, down-regulates the expression of α-amylase/trypsin inhibitor-like protein family as major rice allergens. J Proteome Res. 2013;12(7):3372-3382.
- Kashima K, Yuki Y, Mejima M, Kurokawa S, Suzuki Y, Minakawa S, Takeyama N, Fukuyama Y, Azegami T, Tanimoto T, Kuroda M, Tamura M, Gomi Y, Kiyono H. Good manufacturing practices production of a purification-free oral cholera vaccine expressed in transgenic rice plants. Plant Cell Rep. 2016;35(3):667-679.
- Yuki Y, Nojima M, Hosono O, Tanaka H, Kimura Y, Satoh T, Imoto S, Uematsu S, Kurokawa S, Kashima K, Mejima M, Nakahashi-Ouchida R, Uchida Y, Marui T, Yoshikawa N, Nagamura F, Fujihashi K, Kiyono H. Oral MucoRice-CTB vaccine for safety and microbiota-dependent immunogenicity in humans: a phase 1 randomised trial. Lancet Microbe. 2021;2(9):e429-e440.
- Yuki Y, Nojima M, Kashima K, Sugiura K, Maruyama S, Kurokawa S, Yamanoue T, Nakahashi-Ouchida R, Nakajima H, Hiraizumi T, Kohno H, Goto E, Fujihashi K, Kiyono H. Oral MucoRice-CTB vaccine is safe and immunogenic in healthy US adults. Vaccine. 2022;40(24):3372-3379.
- Tokuhara D, Alvarez B, Mejima M, Hiroiwa T, Takahashi Y, Kurokawa S, Kuroda M, Oyama M, Kozuka-Hata H, Nochi T, Sagara H, Aladin F, Marcotte H, Frenken LG, Iturriza-Gomara M, Kiyono H, Hammarstrom L, Yuki Y. Rice-based oral antibody fragment prophylaxis and therapy against rotavirus infection. J Clin Invest. 2013;123(9):3829-3838.
- Yuki Y, Kurokawa S, Sato S, Sasou A, Matsumoto N, Suzuki A, Sakon N, Goda Y, Takeyama N, Miyoshi T, Marcotte H, Tanaka T, Hammarstrom L, Kiyono H. A heterodimeric antibody fragment for passive immunotherapy against norovirus infection. J Infect Dis. 2020;222(3):470-478.
- Sasou A, Yuki Y, Kurokawa S, Sato S, Goda Y, Uchida M, Matsumoto N, Sagara H, Watanabe Y, Kuroda M, Sakon N, Sugiura K, Nakahashi-Ouchida R, Ushijima H, Fujihashi K, Kiyono H. Development of antibody-fragment-producing rice for neutralization of human norovirus. Front Plant Sci. 2021;12:639953.
- Sato S, Hisaie K, Kurokawa S, Suzuki A, Sakon N, Uchida Y, Yuki Y, Kiyono H. Human norovirus propagation in human induced pluripotent stem cell-derived intestinal epithelial cells. Cell Mol Gastroenterol Hepatol. 2019;7(3):686-688 e685.
- Kiyono H, McGhee JR, Wannemuehler MJ, Frangakis MV, Spalding DM, Michalek SM, Koopman WJ. In vivo immune response to a T-cell-dependent antigen by cultures of disassociated murine Peyer's patch. Proc Natl Acad Sci USA. 1982;79(2):596-600.
- Kiyono H, Cooper MD, Kearney JF, Mosteller LM, Michalek SM, Koopman WJ, McGhee JR. Isotype specificity of helper T cell clones. Peyer's patch Th cells preferentially collaborate with mature IgA B cells for IgA responses. J Exp Med. 1984;159(3):798-811.
- Kiyono H, McGhee JR, Mosteller LM, Eldridge JH, Koopman WJ, Kearney JF, Michalek SM. Murine Peyer's patch T cell clones. Characterization of antigen-specific helper T cells for immunoglobulin A responses. J Exp Med. 1982;156(4):1115-1130.
- Kunisawa J, Gohda M, Hashimoto E, Ishikawa I, Higuchi M, Suzuki Y, Goto Y, Panea C, Ivanov, II, Sumiya R, Aayam L, Wake T, Tajiri S, Kurashima Y, Shikata S, Akira S, Takeda K, Kiyono H. Microbe-dependent CD11b+ IgA+ plasma cells mediate robust early-phase intestinal IgA responses in mice. Nat Commun. 2013;4:1772.
- Beagley KW, Eldridge JH, Lee F, Kiyono H, Everson MP, Koopman WJ, Hirano T, Kishimoto T, McGhee JR. Interleukins and IgA synthesis. Human and murine interleukin 6 induce high rate IgA secretion in IgA-committed B cells. J Exp Med. 1989;169(6):2133-2148.
- Fujihashi K, McGhee JR, Lue C, Beagley KW, Taga T, Hirano T, Kishimoto T, Mestecky J, Kiyono H. Human appendix B cells naturally express receptors for and respond to interleukin 6 with selective IgA1 and IgA2 synthesis. J Clin Invest. 1991;88(1):248-252.
- Xu-Amano J, Beagley KW, Mega J, Fujihashi K, Kiyono H, McGhee JR. Induction of T helper cells and cytokines for mucosal IgA responses. Adv Exp Med Biol. 1992;327:107-117.
- Fujihashi K, McGhee JR, Kweon MN, Cooper MD, Tonegawa S, Takahashi I, Hiroi T, Mestecky J, Kiyono H. γ/δT cell-deficient mice have impaired mucosal immunoglobulin A responses. J Exp Med. 1996;183(4):1929-1935.
- Okahashi N, Yamamoto M, Vancott JL, Chatfield SN, Roberts M, Bluethmann H, Hiroi T, Kiyono H, McGhee JR. Oral immunization of interleukin-4 (IL-4) knockout mice with a recombinant Salmonella strain or cholera toxin reveals that CD4+ Th2 cells producing IL-6 and IL-10 are associated with mucosal immunoglobulin A responses. Infect Immun. 1996;64(5):1516-1525.
- Kiyono H, McGhee JR, Wannemuehler MJ, Michalek SM. Lack of oral tolerance in C3H/HeJ mice. J Exp Med. 1982;155(2):605-610.
- Suzuki I, Kiyono H, Kitamura K, Green DR, McGhee JR. Abrogation of oral tolerance by contrasuppressor T cells suggests the presence of regulatory T-cell networks in the mucosal immune system. Nature. 1986;320(6061):451-454.
- Fujihashi K, Taguchi T, Aicher WK, McGhee JR, Bluestone JA, Eldridge JH, Kiyono H. Immunoregulatory functions for murine intraepithelial lymphocytes: gamma/delta T cell receptor-positive (TCR+) T cells abrogate oral tolerance, while alpha/beta TCR+ T cells provide B cell help. J Exp Med. 1992;175(3):695-707.
- Fujihashi K, McGhee JR, Yamamoto M, Hiroi T, Kiyono H. Role of γδ T cells in the regulation of mucosal IgA response and oral tolerance. Ann N Y Acad Sci. 1996;778:55-63.
- Kweon MN, Fujihashi K, VanCott JL, Higuchi K, Yamamoto M, McGhee JR, Kiyono H. Lack of orally induced systemic unresponsiveness in IFN-gamma knockout mice. J Immunol. 1998;160(4):1687-1693.
- Terahara K, Yoshida M, Igarashi O, Nochi T, Pontes GS, Hase K, Ohno H, Kurokawa S, Mejima M, Takayama N, Yuki Y, Lowe AW, Kiyono H. Comprehensive gene expression profiling of Peyer's patch M cells, villous M-like cells, and intestinal epithelial cells. J Immunol. 2008;180(12):7840-7846.
- Hase K, Kawano K, Nochi T, Pontes GS, Fukuda S, Ebisawa M, Kadokura K, Tobe T, Fujimura Y, Kawano S, Yabashi A, Waguri S, Nakato G, Kimura S, Murakami T, Iimura M, Hamura K, Fukuoka S, Lowe AW, Itoh K, Kiyono H, Ohno H. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 2009;462(7270):226-230.
- Kishikawa S, Sato S, Kaneto S, Uchino S, Kohsaka S, Nakamura S, Kiyono H. Allograft inflammatory factor 1 is a regulator of transcytosis in M cells. Nat Commun. 2017;8:14509.
- Sato S, Kaneto S, Shibata N, Takahashi Y, Okura H, Yuki Y, Kunisawa J, Kiyono H. Transcription factor Spi-B-dependent and -independent pathways for the development of Peyer's patch M cells. Mucosal Immunol. 2013;6(4):838-846.
- Jang MH, Kweon MN, Iwatani K, Yamamoto M, Terahara K, Sasakawa C, Suzuki T, Nochi T, Yokota Y, Rennert PD, Hiroi T, Tamagawa H, Iijima H, Kunisawa J, Yuki Y, Kiyono H. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proc Natl Acad Sci USA. 2004;101(16):6110-6115.
- Kiyono H, McGhee JR, Michalek SM. Lipopolysaccharide regulation of the immune response: comparison of responses to LPS in germfree, Escherichia coli-monoassociated and conventional mice. J Immunol. 1980;124(1):36-41.
- Obata T, Goto Y, Kunisawa J, Sato S, Sakamoto M, Setoyama H, Matsuki T, Nonaka K, Shibata N, Gohda M, Kagiyama Y, Nochi T, Yuki Y, Fukuyama Y, Mukai A, Shinzaki S, Fujihashi K, Sasakawa C, Iijima H, Goto M, Umesaki Y, Benno Y, Kiyono H. Indigenous opportunistic bacteria inhabit mammalian gut-associated lymphoid tissues and share a mucosal antibody-mediated symbiosis. Proc Natl Acad Sci USA. 2010;107(16):7419-7424.
- Fung TC, Bessman NJ, Hepworth MR, Kumar N, Shibata N, Kobuley D, Wang K, Ziegler CGK, Goc J, Shima T, Umesaki Y, Sartor RB, Sullivan KV, Lawley TD, Kunisawa J, Kiyono H, Sonnenberg GF. Lymphoid-tissue-resident commensal bacteria promote members of the IL-10 cytokine family to establish mutualism. Immunity. 2016;44(3):634-646.
- Sonnenberg GF, Monticelli LA, Alenghat T, Fung TC, Hutnick NA, Kunisawa J, Shibata N, Grunberg S, Sinha R, Zahm AM, Tardif MR, Sathaliyawala T, Kubota M, Farber DL, Collman RG, Shaked A, Fouser LA, Weiner DB, Tessier PA, Friedman JR, Kiyono H, Bushman FD, Chang KM, Artis D. Innate lymphoid cells promote anatomical containment of lymphoid-resident commensal bacteria. Science. 2012;336(6086):1321-1325.
- Shibata N, Kunisawa J, Hosomi K, Fujimoto Y, Mizote K, Kitayama N, Shimoyama A, Mimuro H, Sato S, Kishishita N, Ishii KJ, Fukase K, Kiyono H. Lymphoid tissue-resident Alcaligenes LPS induces IgA production without excessive inflammatory responses via weak TLR4 agonist activity. Mucosal Immunol. 2018;11(3):693-702.
- Shimoyama A, Di Lorenzo F, Yamaura H, Mizote K, Palmigiano A, Pither MD, Speciale I, Uto T, Masui S, Sturiale L, Garozzo D, Hosomi K, Shibata N, Kabayama K, Fujimoto Y, Silipo A, Kunisawa J, Kiyono H, Molinaro A, Fukase K. Lipopolysaccharide from gut-associated lymphoid-tissue-resident Alcaligenes faecalis: Complete atructure determination and chemical synthesis of Its Lipid A. Angew Chem Int Ed Engl. 2021;60(18):10023-10031.
- Liu Z, Hosomi K, Shimoyama A, Yoshii K, Sun X, Lan H, Wang Y, Yamaura H, Kenneth D, Saika A, Nagatake T, Kiyono H, Fukase K, Kunisawa J. Chemically synthesized alcaligenes Lipid A as an adjuvant to augment immune responses to Haemophilus Influenzae type B conjugate vaccine. Front Pharmacol. 2021;12:763657.
- Goto Y, Lamichhane A, Kamioka M, Sato S, Honda K, Kunisawa J, Kiyono H. IL-10-producing CD4(+) T cells negatively regulate fucosylation of epithelial cells in the gut. Sci Rep. 2015;5:15918.
- Goto Y, Obata T, Kunisawa J, Sato S, Ivanov, II, Lamichhane A, Takeyama N, Kamioka M, Sakamoto M, Matsuki T, Setoyama H, Imaoka A, Uematsu S, Akira S, Domino SE, Kulig P, Becher B, Renauld JC, Sasakawa C, Umesaki Y, Benno Y, Kiyono H. Innate lymphoid cells regulate intestinal epithelial cell glycosylation. Science. 2014;345(6202):1254009.
- Goto Y, Uematsu S, Kiyono H. Epithelial glycosylation in gut homeostasis and inflammation. Nat Immunol. 2016;17(11):1244-1251.
- Kurashima Y, Amiya T, Fujisawa K, Shibata N, Suzuki Y, Kogure Y, Hashimoto E, Otsuka A, Kabashima K, Sato S, Sato T, Kubo M, Akira S, Miyake K, Kunisawa J, Kiyono H. The enzyme Cyp26b1 mediates inhibition of mast cell activation by fibroblasts to maintain skin-barrier homeostasis. Immunity. 2014;40(4):530-541.
- Kurashima Y, Yamamoto D, Nelson S, Uematsu S, Ernst PB, Nakayama T, Kiyono H. Mucosal mesenchymal cells: Secondary barrier and peripheral Eeducator for the gut immune system. Front Immunol. 2017;8:1787.
- Kurashima Y, Kiyono H. Mucosal ecological network of epithelium and immune cells for gut homeostasis and tissue healing. Annu Rev Immunol. 2017;35:119-147.
- Kamioka M, Goto Y, Nakamura K, Yokoi Y, Sugimoto R, Ohira S, Kurashima Y, Umemoto S, Sato S, Kunisawa J, Takahashi Y, Domino SE, Renauld JC, Nakae S, Iwakura Y, Ernst PB, Ayabe T, Kiyono H. Intestinal commensal microbiota and cytokines regulate Fut2(+) Paneth cells for gut defense. Proc Natl Acad Sci USA. 2022;119(3).
- Kurashima Y, Amiya T, Nochi T, Fujisawa K, Haraguchi T, Iba H, Tsutsui H, Sato S, Nakajima S, Iijima H, Kubo M, Kunisawa J, Kiyono H. Extracellular ATP mediates mast cell-dependent intestinal inflammation through P2X7 purinoceptors. Nat Commun. 2012;3:1034.
- Kurashima Y, Kigoshi T, Murasaki S, Arai F, Shimada K, Seki N, Kim YG, Hase K, Ohno H, Kawano K, Ashida H, Suzuki T, Morimoto M, Saito Y, Sasou A, Goda Y, Yuki Y, Inagaki Y, Iijima H, Suda W, Hattori M, Kiyono H. Pancreatic glycoprotein 2 is a first line of defense for mucosal protection in intestinal inflammation. Nat Commun. 2021;12(1):1067.

